杂和的RNA超分子系统:
一种生命起源的新解释,
以及发展新型配体和催化剂的新方法
The Decorated RNA Supermolecular World and A Method to Develop Novel Ligands and Catalysts
王天欣 wtx@wtxtech.com
Abstract:
A new theory for the origin of life has been proposed. Based on this theory,
instead of a single-strained
“pure” RNA, the
RNA (DNA) supermolecular system
consisting of several partially complementary RNA (DNA) strands, among which,
some are covalently modified by
other molecules (such as amino acid and peptide) were the key bio molecules in
the primitive soup and the missing
links between RNA world and Protein world.
This type of supermolecular systems is also very useful in developing novel
ligands, catalysts and molecular devices.
摘要:
本文提出杂和的RNA超分子系统理论可以作为生命起源的新解释,
以及发展新型配体和催化剂的新方法.
依照这个理论,
在生命发展的初期阶段,
RNA超分子系统是最重要的生物活性物质.
RNA (DNA) 超分子系统是由几条部分互补的RNA
(DNA) 组成的超分子自组装体系,
其中的某些核酸是被其它非核酸物质共价修饰了的.
正文:
近些年来,
多种催化性RNA和DNA
被应用定向进化方法不断发现.
这些催化性核酸的发现支持了RNA世界理论[1].
RNA世界理论认为
RNA 在导致生命起源的化学过程中起了主导作用,
既是功能性分子又是遗传性分子.
由于结构决定功能,
为了克服化学上核酸只有四个碱基的结构局限,
研究者们提出了数种创造性的策略,
主要是引进辅酶和非天然碱基[2 ].
尽管如此,
催化性核酸的功能和效率仍未能充分发挥,
远远未能达到能够完成原始生命活动的程度.
这是否意味着现在应用定向进化方法人工产生的催化性核酸的结构类型仅仅是生命进化初级阶段曾经存在的催化性核酸的结构类型的一小部分?
目前在应用定向进化方法人工产生催化性核酸时,
所用的核酸库是类似长度单股纯RNA.
很难想象这会发生在生命进化初级阶段的原生汤中.
基于以上讨论,
我们提出以下的问题:
在RNA世界中的催化性核酸是否一定要是单股纯RNA
? 它们是否可以是由几条部分互补的RNA组成的RNA超分子自组装体系,
其中的某些RNA是被其它非核酸物质共价修饰了的?
Orgel’s
关于核酸的 genetic
take over
[3] 的研究证实在以一条长链核酸为模板进行自我复制时,
会产生许多不同长度的短链互补核酸.
这个试验意味着在核酸原生汤中,
不仅会有许多长链核酸,
还更可能有更多短链与长链核酸互补的核酸,
尤其在高效的核酸聚合酶还未进化出来时.
于是核酸超分子自组装体系的产生将是一个常见现象
(图 1).
由此可以期待,
在生命初起阶段,
有些催化性核酸可能是单股RNA,
而另一些则可能是由数条部分互补RNA构成的自组装超分子系统,
类似于如今一些蛋白是由数个亚基组成一样.
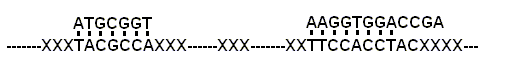
图 1. 核酸超分子自组装体系
(x: 可变化的核酸)
自组装超分子系统的优点在于更复杂的结构和更高的分子多样性可以由较少和较小的模块构成,
如同双链抗体的产生策略.
其潜在的弊端是较高的分子柔度可能会降低分子的活性,
于是引入非核酸构成模块便成为一个必需.
由于原生汤中即包括氨基酸又包括核酸,
这两类主要生物分子极有可能会发生化学作用.
首先,
对于磷酰氨基酸的研究证实 [4]
它能在温和环境下产生短肽链修饰的核酸,
从而意味着在原生汤中某些化学活性物质会产生多肽与核酸的杂合体.
其次,
氨基酸转移催化性核酸的发现 [5]
揭示了氨基酸-核酸杂合体
(图.2)
存在的可能性.
考虑到越来越多能在RNA底物上催化烷基化,
酰基化,
环化加成等反应,
产生
RNA-其它非核酸分子结合体的催化性核酸被不断发现 [6]
, 我们可以预期在原生汤中也会存在类似的小分子修饰的
RNA 和
DNA(图 3).
有些被修饰的长链核酸将会有新的催化功能,
因为引入新的功能基可以克服核酸的结构局限从而有利于产生新的活性.
图 2 氨基酸-核酸杂化体
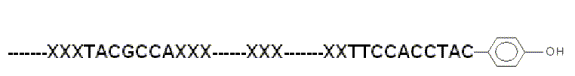
图 3
RNA-其它非核酸分子结合体
目前多数人工制备的催化性核酸的催化活性是自我修饰.
一个酶可以自我修饰然后具有其它催化功能是罕见的.
在原生世界里,
一个更为可能的策略则是:
一组酶以氨基酸或其它分子修饰另一组较短的,部分互补的核酸
(图 2)
; 被修饰的短链核酸然后与长链核酸自组装成超分子系统
(图 4). 这些超分子系统中的某些系统便有可能催化特定反应.
这个假设可以用来解释为什么目前多数催化性核酸的底物是核酸片断.
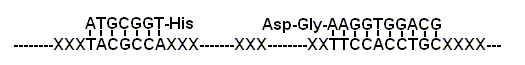
图 4 一个氨基酸修饰的 RNA
系统, 可以被理解为一个利用RNA编码的氨基酸辅酶的RNA
假如生命的确是由
RNA 世界产生,
那么一个混合的修饰过的RNA
世界明显比一个单股的纯RNA
世界更加合理. 实际上,
第一个被发现的催化性核酸也是一个超分子系统,
不仅包括RNA,
还包括
Mg2+ 和鸟苷.
近来发现的
RNA-RNA 相互作用可以调节 RNA
合成又一次给我们显示了互补碱基配对的力量 [7].
可以想象大自然会利用这样的超分子系统来制作更复杂的催化性核酸,
因为碱基配对是构成生物功能如此巧妙的工具.
在漫长的进化过程中,
在自然选择的压力下,
由于氨基酸的结构多样性远远超过核酸(
20种:
4种),
其对应的活性与功能也远远超过核酸,
于是核酸骨架上的氨基酸和多肽链变得越来越长而核酸部分则越来越短以至于最终完全消失,
从而完成了从核酸酶到蛋白酶的进化.
根据这个假说,
现在生物的某些内含子则是那些互补核酸片断的遗迹,
而多肽修饰的RNA(或DNA)
则是进化过程中连接核酸酶与蛋白酶的迷失链节.
近来应用单一氨基酸为辅酶的催化性
DNA 已被成功制备 [2 ].
可以想象催化性核酸更容易利用DNA 编码的辅酶
(图.
5) 来扩展其催化潜力.
如今,生物体内仍然存在基于核苷的辅酶,
如
NADH 和其它核酸杂合物如
tRNA, 它们则可能是这类古代核酸编码辅酶的遗迹.
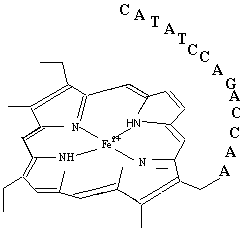
图.5
一个DNA 编码的辅酶:
DNA-卟啉杂和物
在应用定向进化以发展新型配体和催化剂时,应用如上所述的核酸编码的辅酶也将会有巨大的意义.
在应用如下的
RNA (DNA) 库进行定向进化时:
----XXXXXXXXATTGGCTTCGXXXXXXXXTATACCCXXX---,
我们可以将人工合成的部分互补的
RNA, DNA, or PNA (肽核酸)
杂合片断如 TAAXXXXCCGAA-Gly,
ATATGGG-Ala,
和
ATATGGG-His 等加入进化系统以形成一个超分子系统库.
所进化出的超分子结构则可能因其包括的氨基酸部分而具有更卓越的活性.
当代化学的进展使我们有几乎无限的新型结构如非天然小分子,
络合物-金属;离子,
辅酶以及更大的系统如
C60 , 分子电路,
纳米颗粒和元件可以利用.
它们都可以由有机合成自由地连接到核酸片断上.
结构决定功能,
通过向定向进化体系中引入这些新型的构建模块
(图 6),
我们可以在创造新的功能上比大自然做得更好.
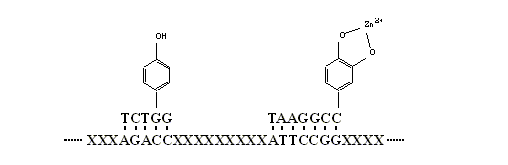
图
6 一个修饰过的
DNA 超分子体系文库,
含有新型功能基以提供新的功能与活性
Reference:
1) Walter Gilbert: Nature, 1986, Vol.319,
618
2) Kandasamy Sakthivel,
Carlos F. Barbas: Angew. Chem .Int.
Ed. 1998 (37), 2872
Adam Roth, Ronald R.
Breaker: Proc. Natl. Acad. Sci. USA
1998 (95)
6027-6031
T.M.Tarasow, S.L.Tarasow,
B.E.Eaton: Nature, 1997,389,54-57
3) Christof Bohler, Peter E.
Nielsen, Leslie E. Orgel: Nature, 1995, 376,
578-581;
4) Zhao Yufeng, Li Yanmei:
J. of Biochemical Physics, 1994, 20, 283-287; Chinese Chemical Letter, 1996, Vol 7. No 10, 905-906,
5) Lohse P.A, Szostak J.W:
Nature, 1996, 381,
442-444
6) Peter J. Unrau, David P.
Bartel Nature 1998, 395,
260-263;
Wilson C, Szostak J.W: Nature, 1995, 374 ,777-783;
Illangasekare M, Sanches G,
Nickles T, Yarus M, Science, 1995,267,643-647
7) Sit T.L, Vaewhongs A.A, Lommel S.A. Science 1998 , 281, 829-832